Galectin-9 inhibition of the MIF-CD74/CD44 pathway suppresses chronic arthritis
Meiling Li1,2,9 ∙ Min-Kyung Nam1,9 ∙ Jung Gon Kim3,4,9 ∙ Juyeon Kang3 ∙ Se-Hyeon Park1,3 ∙ Su-Hyun Lee1,3 ∙ Chaerin Kim1,3 ∙ David Song5 ∙ Jingchun Jin6∙ Seung-Ah Yoo1,3 ∙ Richard Bucala7 ∙ Wan-Uk Kim1,3,8
1) Department of Biomedicine & Health Sciences, Department of Medical Life Sciences, College of Medicine, The Catholic University of Korea, Seoul, Korea
2) Department of Rheumatology and Immunology, The Second Affiliated Hospital of Soochow University, Suzhou, China
3) Center for Integrative Rheumatoid Transcriptomics and Dynamics, The Catholic University of Korea, Seoul, Korea
4) Department of Internal Medicine, Inje University Ilsan Paik Hospital, Goyang, Korea
5) GBIOLOGICS, Seongnam, Korea
6) Department of Immunology of Yanbian University Hospital, Yanji, Jilin Province, China
7) Department of Internal Medicine, Yale University School of Medicine, New Haven, CT, USA
8) Department of Internal Medicine, The Catholic University of Korea, Seoul, Korea
9) These authors contributed equally
초록
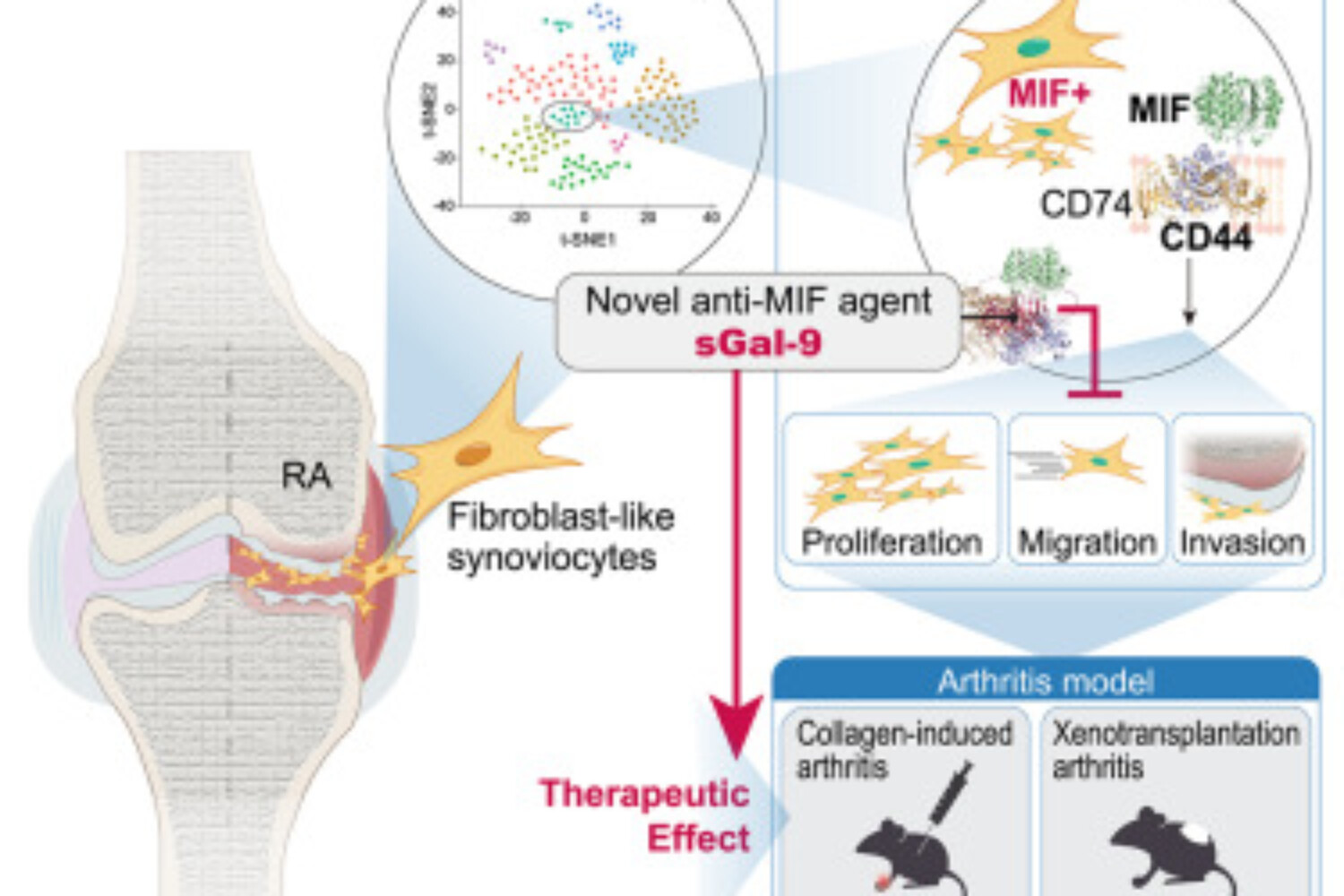
류마티스 관절염(RA)의 파괴적 잠재력은 섬유아세포 유사 활막세포(FLS)의 공격적인 행동에 기인합니다. 섬유아세포 유사 활막세포는 연골과 뼈의 침식에 적극적으로 기여하며, 임상적으로 완화된 증상이 나타나더라도 지속될 수 있습니다. RA-FLS를 표적으로 하는 치료법이 RA 치료를 위해 개발되었지만, 현재 임상적으로 승인된 약물은 없습니다. 본 연구에서는 RA-FLS의 단일 세포 RNA 시퀀싱을 통해 미토콘드리아와 소포체 기능 장애를 가진 독특한 대식세포 이동 억제 인자(MIF) 발현 증가 아형을 확인했습니다. MIF 발현 증가 조건은 FLS의 생존, 증식 및 이동을 증가시켰으며, CD44와 CD44v6 동형 발현의 상향 조절을 유도했습니다. 다음으로, CD44 차단제 역할을 하는 안정적인 재조합 형태의 갈렉틴-9(sGal-9)가 RA-FLS의 MIF 유도 공격적인 표현형을 조절하는지 여부를 조사했습니다. sGal-9가 MIF-CD44 경로를 억제함으로써 RA-FLS의 증식, 이동, 그리고 침윤 증가를 현저히 감소시키는 것을 확인했습니다. 또한, sGal-9의 국소 및 전신 투여는 이종이식 관절염 모델에서 RA-FLS에 의한 과도한 연골 및 골 파괴를 상당히 억제했으며, 마우스에서 콜라겐 유도 관절염의 중증도를 엔브렐 및 토파시티닙과 유사하게 완화시켰습니다. 결론적으로, 이러한 결과는 sGal-9가 새로운 항-MIF 제제로서 RA-FLS의 파괴적인 표현형을 억제하는 데 효과적임을 시사합니다.
Abstract
The destructive potential of rheumatoid arthritis (RA) lies in the aggressive behavior of fibroblast-like synoviocytes (FLSs), which actively contribute to the erosion of cartilage and bone and may persist even in the face of apparent clinical remission. Therapeutic approaches targeting RA-FLSs have been developed to treat RA; however, there are no clinically approved drugs available at present. Here, single-cell RNA sequencing of RA-FLSs identified a distinct macrophage migration inhibitory factor (MIF)high subset with mitochondrial and endoplasmic reticulum dysfunction. MIFhigh conditions led to increased survival, proliferation, and migration of FLSs, along with the upregulation of CD44 and the CD44v6 isoform expression. We next explored whether a stable, recombinant form of galectin-9 (sGal-9), which acts as a CD44 blockade, regulates the MIF-induced aggressive phenotype of RA-FLSs. We found that sGal-9 remarkably reduced the increased proliferation, migration, and invasion of RA-FLSs by inhibiting the MIF-CD44 pathway. Moreover, both local and systemic administration of sGal-9 substantially inhibited excessive cartilage and bone destruction by RA-FLSs in a xenotransplantation arthritis model and alleviated the severity of collagen-induced arthritis in mice, comparable to Enbrel and tofacitinib. Conclusively, these data suggest that sGal-9 is effective at repressing destructive phenotypes of RA-FLSs as a novel anti-MIF agent.